Sisu
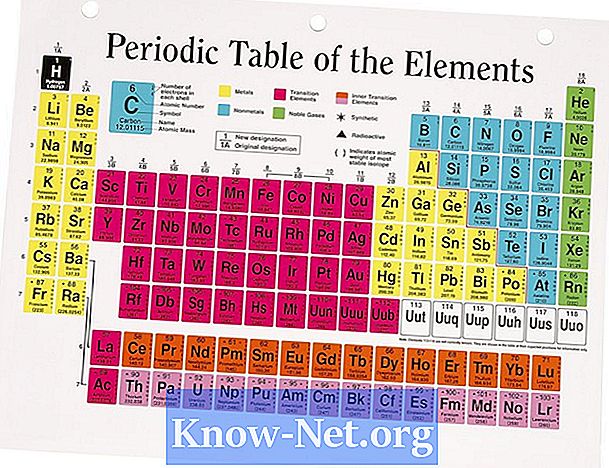
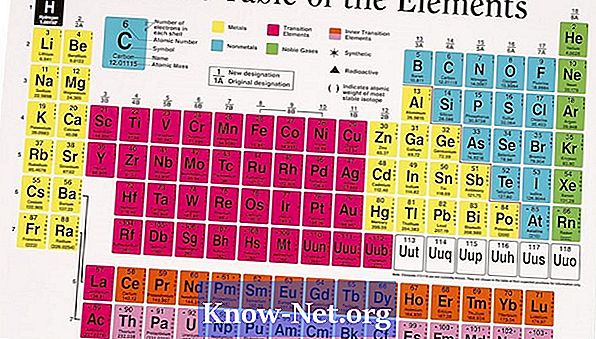
Enamik elemente esineb looduses rohkem kui ühe isotoobi kujul. Looduslikult esinevate isotoopide arvukus mõjutab elemendi keskmist aatommassi. Perioodilises tabelis leitud aatomimass on erinevate isotoopide väärtuste keskmine, mis arvestab igaühe arvukust. Elementide puhul, millel on ainult üks isotoop, on aatomimass lähedane eeldatavale väärtusele, mis põhineb tuumade prootonite ja neutronite arvul.
Juhised
-
Vaadake huvipakkuva elemendi võimalikku isotoopi. Kõikidel elementidel on vähemalt isotoop. Aatomimassi arvutamiseks peate teadma, kui palju on isotoope, nende arvukust ja aatomimassi.
-
Leia iga isotoobi loomulik arvukus ja märkige need väärtused elemendi isotooparvuga.
-
Aatomimass arvutatakse kaalutud keskmise põhjal. Korrutage iga isotoobi protsentuaalne arvukus ja lisage kõik väärtused. Näiteks magneesiumil on kolm isotoopi: Mg (24), Mg (25) ja Mg (26), mille protsendid on 78,9%, 10% ja 11,1% ning mille massid on 23 985, 24 986 ja 25 983, vastavalt. Kaalutud keskmine arvutatakse valemiga (1 x aatommass) + (protsent 2 x aatommass) + (3 x aatommass) ((0,899 x 23,985) + (0,1 x 24,986) + (0,111 x 25,983) = 18,924 + 2,499 + 2,884 = 24,307. Avaldatud väärtus on 24 305. Väärtuste ümardamine õigustab väikest erinevust.
Mida sa vajad
- Elemendi isotoobid
- Protsentide arvukus


